Diagnóstico Genético Pré-implantacional PGS e PGD (PGT-A e PGT-M)
O IPGO realiza exame genético dos embriões antes da implantação para o diagnóstico precoce de doenças cromossômicas e genéticas
PGD (Pre-ImplantationGeneticDiagnosis) e o PGS (Pre-ImplantationGeneticScreening) são exames que podem ser utilizados no processo fertilização in vitro (FIV), com o objetivo de diagnosticar nos embriões a existência de alguma doença genética antes da implantação no útero da mãe. Assim, casais com chances de gerar filhos com problemas genéticos como Síndrome de Patau (trissomia do cromossomo 13), Síndrome de Edwards (trissomia do cromossomo 18), Síndrome de Down (trissomia do cromossomo 21), Síndrome do Klinefelter (47XXY), distrofia muscular, hemofilia, entre outras anomalias genéticas, podem descobrir se o embrião possui tais doenças por meio deste exame. Tanto o PGD como PGS consistem na retirada de algumas células do embrião (biópsia embrionária), em laboratório, e encaminhado para análise, antes mesmo de ele ser colocado no útero. Este procedimento não afeta o futuro bebê. Os embriões com problemas não devem, então, ser transferidos. A diferença entre PGD e PGS está no tipo de análise genética realizada:
• PGD (examina doenças genéticas), diagnóstico genético pré-implantação, envolve a remoção de algumas células de um embrião de FIV para testá-lo para uma condição genética específica (fibrose cística, Doença de Gaucher entre outras, por exemplo) antes da transferência do embrião para o útero. • PGS (examina doenças cromossômicas), o rastreio genético pré-implantação, é o termo apropriado para testar a normalidade total cromossômica nos embriões. O PGS não está à procura de um diagnóstico da doença específica – é o rastreio do embrião para números de cromossomos normais. Com isso sabemos se o embrião tem alguma síndrome cromossômica como Síndrome de Down, Patau, Edwards e outras. Dessa forma, o PGD é realizado quando um casal tem história familiar de alguma doença relacionada a algum gene específico. Quando queremos ver somente a integridade dos cromossomos, utilizamos o PGS, sendo este muito mais utilizado.
PGT-A e PGT-M: NOVAS SIGLAS PARA DIAGNÓSTICO GENÉTICO PRÉ-IMPLANTACIONAL
PGS tem sido a sigla que a maioria das clínicas vinham utilizando para definir o screening genético pré-implantacional, referindo-se ao rastreamento dos 24 cromossomos na amostra de células do embrião biopsiado durante o tratamento de FIV (Fertilização in Vitro). Estas siglas haviam sido adotadas para substituir a anterior terminologia PGD, que então passou a ser utilizada somente para o diagnóstico genético pré-implantacional para doenças monogênicas. Esta sopa de letras frequentemente gerava confusão. Por isso, para facilitar o entendimento e padronizar, o diagnóstico genético pré-implantacional passa a ser tratado por todos como teste genético pré-implantacional (PGT), e são agregados complementos associados ao tipo de diagnóstico genético em questão:
• PGT-A: Lembre-se A de aneuploidia, ou seja, o diagnóstico que identifica a saúde cromossômica do embrião. Este estudo é realizado para ajudar a oferecer um tratamento de Fertilização in Vitro (FIV) mais efetivo, pois permite identificar o embrião saudável com possibilidade ampliada de implantação e risco reduzido de abortamento e doenças cromossômicas como a Síndrome de Down, que estão principalmente relacionadas com a idade materna avançada e alterações no cariótipo do casal.
• PGT-M:Lembre-se M de monogênica, onde o diagnóstico do embrião tem o objetivo de identificar aqueles que foram afetados por uma alteração genética que dá origem a uma doença hereditária. Um estudo indicado para famílias onde existem casos de doenças monogênicas hereditárias, tais como Anemia Falciforme, Fibrose Cística, entre outras.
Para ver o vídeo que descreve o processo de forma lúdica – O Teste PGS melhora o sucesso dos Tratamentos de Fertilização in Vitro (FIV) – clique aqui (versão em inglês)
QUEM SE BENEFICIA DO PGS?
O screeninggenético pré-implantacional (PGS) pode ser indicado para todos os casais, mas a principais indicações são para casais com mulheres com idade avançada ( mais de 40 anos) ou quando um dos parceiros do casal tiver alterações cromossômicas como as translocações, inversões ou polimorfismos.
A importância destes três últimos vai depender do histórico reprodutivo de cada paciente como, por exemplo, tempo de tentativas de gravidez, abortos e falhas de tratamentos anteriores.
Quanto a idade materna, a medida que a mulher envelhece, aumentam também as chances de gerar um embrião cromossomicamente alterado, não importando o número de embriões fertilizados.
A translocação cromossômica é uma anomalia cromossômica causada pelo rearranjo de partes entre cromossomos. Existem dois tipos principais detranslocação cromossômica: a translocação recíproca, também conhecida como não-Robertsoniana e a translocação Robertsoniana. Além disso, as translocações podem ser balanceadas (sem perda ou acréscimo de material genético) ou não-balanceadas (quando a troca de material cromossômico é desigual resultando em genes extras ou ausentes).
A Inversão cromossômina é a ocorrência de duas quebras em um cromossomo e a soldadura em posição invertida do fragmento ao restante do cromossomo. A inversão é dita paracêntrica se as quebras ocorrerem em um mesmo braço cromossômico, e é denominada pericêntrica se o fragmento cromossômico invertido incluir o centrômero.
Polimorfismocromossômico são alterações da estrutura cromossômica(as mais importantes sãos as alterações da heterocromatina).
INDICAÇÕES:
O PGS está indicado nas seguintes situações:
✔ casais com alterações no cariótipo que apresentam risco elevado de alteração cromossômica na prole;
✔ idade materna avançada;
✔ história familiar de doenças cromossômicas;
✔ antecedente de filho com alteração cromossômica;
✔ cariótipo alterado de pelo menos de um dos membros do casal (translocação, inversão ou polimorfismo);
✔ falhas de tratamentos prévios de FIV;
✔ aborto de repetição;
Veja os dados apresentados nas estatísticas apresentadas abaixo:
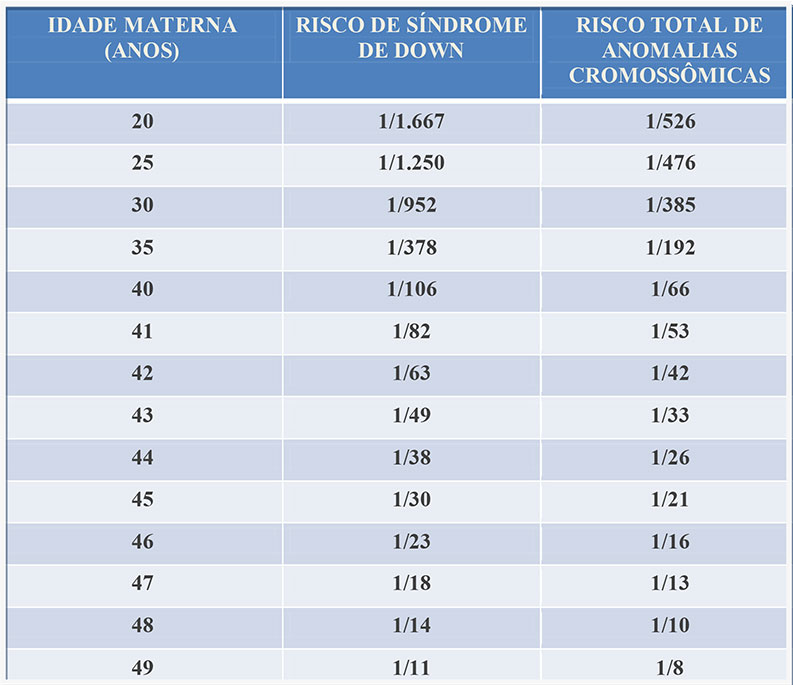
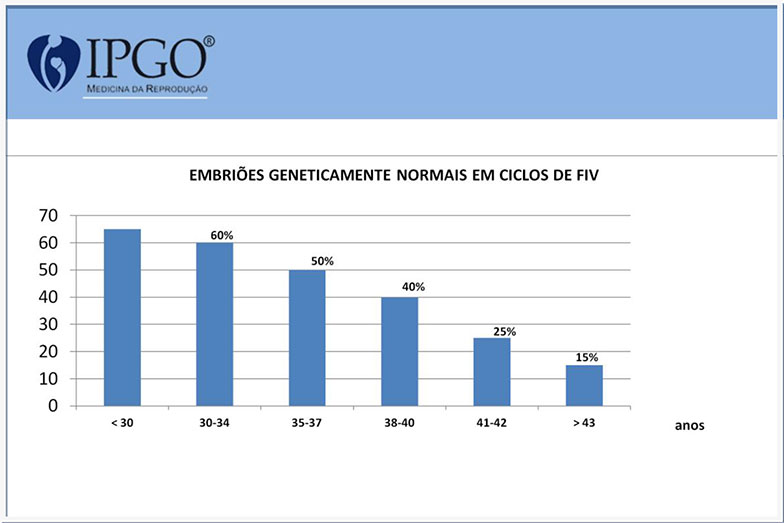
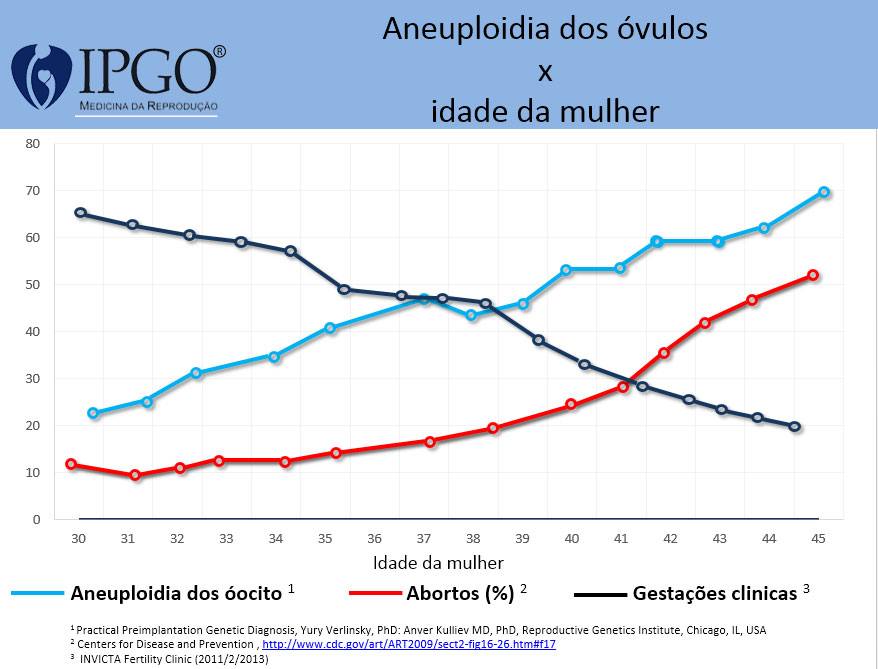
Dados da Reprogenetics (2015): 10.852 ciclos com 58.798 embriões
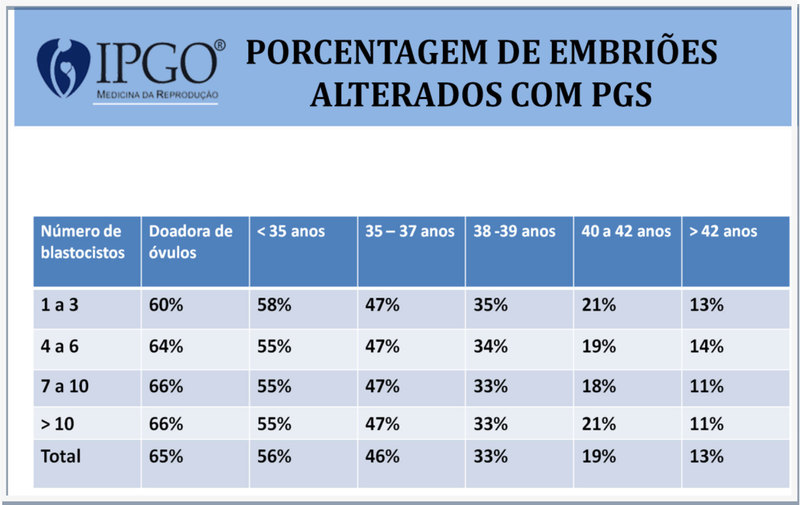
COMO O PGS MELHORA AS TAXAS DE SUCESSO NOS TRATAMENTOS DE FIV?
PGS demonstrou inúmeros benefícios, entre eles:
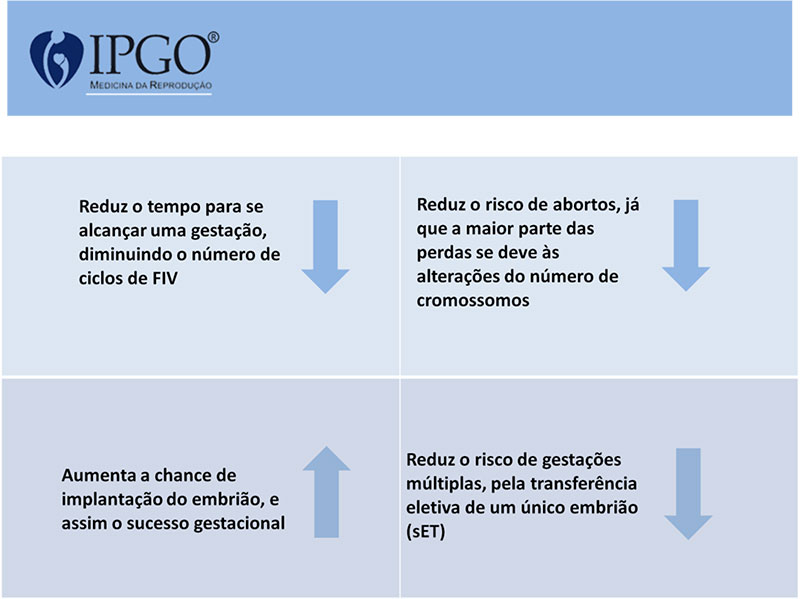
CUIDADOS E REFLEXÕES NAS INDICAÇÕES DO EXAME (O “FALSO POSITIVO”)
Apesar de seus benefícios, este exame pode apresentar resultados “falso positivo”, ou seja, indicar que o embrião é alterado, quando na verdade é normal, o que levaria ao descarte de um embrião saudável. Esta possibilidade de “falso positivo” ou “falso negativo” é possível e previsível neste tipo de exame. Em outras palavras,o exame PGS pode levar a um tratamento MAIS EFICIENTE por minimizar as possibilidades de anomalias no bebê e aumentar a probabilidade de resultados positivos na FIV, pois a maioria dos embriões com anomalias não chega a implantar ou termina em aborto no início da gestação, uma vez que é esperado que parte dos embriões formados na FIV sejam anormais, ( NÃO SAUDÁVEIS), sendo uma importante causa de falha de FIV (Quadro 2). Por outro lado, um ensaio clínico realizado por Scott et al demonstrou que a possibilidade de “falsos positivos” ( embriões saudáveis diagnosticados como anormais e serem descartados) pode ocorrer em até 4% dos casos e tornar o tratamento MENOS EFICAZ. Se houver falso positivo, podemos estar descartando a única chance de a paciente engravidar.
Qual a diferença entre eficiência e eficácia?
A diferença entre eficácia e eficiência é que enquanto a eficácia refere-se a fazer a tarefa certa, completar atividades e alcançar metas, a eficiência é sobre fazer as coisas de forma otimizada, de maneira mais rápida ou com menos gastos. Em termos gerais:
Eficaz: É algo adequado para atingir um propósito, de modo a alcançar o resultado pretendido ou esperado.
Eficiente: Quando a tarefa é executada da melhor maneira possível, com o menor desperdício de tempo, esforço e recursos.
O motivo disso é o fato da biópsia ser realizada na porção do embrião que originará a placenta, onde pode ocorrer mosaicismo, ou seja, haver células alteradas entre as normais e esta alteração nem sempre se reflete no embrião. Mosaicismo é a presença de duas ou mais linhagens de células com diferentes constituições cromossômicas . Frente a isso, alguns autores vem se posicionando contrário a realização do exame em pacientes com baixa resposta na estimulação ovariana, pois produzem menos óvulos e menos embriões . Publicações como uma meta-análise de Mastenbroeketal, que revisou a literatura médica, incluindo nove ensaios clínicos concluiu que em pacientes com idade avançada, realizar o PGS diminui a chance de bebês nascidos vivos que foram concebidos por FIV. O PGS já foi ainda questionado por outros autores. Esfandiarietal demonstraram algumas discrepâncias no resultado de PGS do mesmo embrião, enviado para diferentes centros. O mesmo embrião teve resultado normal ou alterado quando o exame era realizado em clínicas diferentes. Orvietoetal, no congresso ESHRE de 2014, também demostraram que 20% dos casos são inconclusivos na biópsia e mais 16% apresentam mosaicismo.
Frente a estes questionamentos, um estudo realizado pelo “Center of Human Reproduction” (Centro de Reprodução Humana) de Nova York, em conjunto com outros centros também desta cidade, adotaram a política de, na falta de embrião euploide (normal) na biópsia, transferir os embriões alterados com monossomia (presença de somente um cromossomo ao invés de um par). Os resultados, mostraram que, dos 5 pacientes que transferiram embriões alterados na biópsia, 3 tiveram partos de um bebê saudável. São 3 casos em que os embriões seriam descartados. As técnicas de PGS vem evoluindo, diminuindo a chance de falsos positivos, mas ainda isso não é 100%.
Entretanto, essas técnicas não devem se tornar um procedimento de rotina para todas as mulheres que desejam engravidar. Além do custo do exame, existem alguns princípios éticos do casal que devem ser respeitados, como a aceitação de uma seleção natural e a não concordância do descarte dos embriões que apresentarem problemas. Devem ainda ter indicações restritas às reais necessidades, pois estes exames não são isentos de riscos de falsos positivos e falsos negativos.
Mosaicismo
ipos de mosaicismo de blastocistos e opções de biópsia de trophectodermo (TE). Existem vários tipos de mosaicismo de blastocistos de acordo com a linhagem cellular afetada. Quando a população de células TE inclui células aneuploides e euploides (“Mosaico Total” ou “TE Mosaico”), a biópsia pode incluir linhagens cellular e sou apenas células uploides ou uploides. De acordo com a localização da biópsia, os diagnósticos serão mais ou menos precisos. Quando o mosaicismo é confinado à massa cellular interna (“Mosaico ICM”), a biópsia TE será sempre totalmente egoítica, como a TE e não representará a população celular total no embrião, dando um diagnostic errado. Da mesma forma, quando o ICM e TE são cromossômicos distintos (ICM / TE Mosaic “), a biópsia de trophectoderm sempre mostrará os diagnósticos contrários, aneuploides versus euploides, ao observado no ICM.

TÉCNICAS DE PGS
Existem várias técnicas de PGS. Inicialmente havia FISH, que analisava no máximo 11 cromossomos, tendo sido substituído pelo aCGH que analisa todos os cromossomos. Mais recente, surgiu o GeniSeq24 ou NGS, que também analisa os 24 cromossomos, mas com algumas vantagens em relação ao aCGH. Hoje o NGS é a técnica mais utilizada. Há ainda o SNP, que consegue mais análises, com custo muito mais elevado, utilizado, portanto, em casos especiais.
GeniSeq 24 – Next GenerationSequencing (NGS):
O NGS é uma tecnologia para o Diagnóstico Pré-Implantacional que vem substituindo o aCGH. O NGS estuda o genoma em larga escala: lê grandes fragmentos de DNA selecionados para conformar um painel genético que dará respostas sobre grupos de doenças ou condições genéticas em sistemas orgânicos, checando anormalidades no número de cromossomos (estruturas que guardam os genes), identificando partes que faltam ou sobram. Também tem potencial para apontar, no futuro, simultaneamente, mutações em genes e variações em uma região do código genético que é herdada exclusivamente da mãe, chamada de DNA mitocondrial (embora ainda não utilizado para este fim).
O QUESTIONAMENTO DO IPGO:
1. É recomendável realizar a biópsia embrionária em pacientes com poucos embriões?
R: O IPGO pensa que NÃO
2. Em que situações o IPGO recomenda este exame?
R: O IPGO considera aceitável a indicação em pacientes com histórico familiar de anomalias cromossômicas, cariótipo alterado de um dos membros do casal, abortos repetidos falhas repetidas de tratamentos anterioressem explicaçõese mulheres com idade avançada que produzam uma quantidade “razoável” de óvulos.
INTERPRETAÇÃO DOS RESULTADOS:
Normal:
Um resultado normal indica a presença de 46 cromossomos completos, incluindo 22 pares de autossomos e umpar de cromossomos sexuais. Um resultado normal será reportado se 2 cromossomos para cada autossomo (1 até 22) e 2 cromossomos sexuais forem encontrados.
Monossomia:
Monossomia é um estado no qual um cromossomo de um par normal é ausente. A maioria das monossomias não são compatíveis com a vida. Monossomia será relatada se houver qualquer cromossomo ausente. Orelatório vai mostrar um “-” antes do autossomo afetado (cromossomos 1-22) e “anormal” no campo de resultado.
Trissomia:
Trissomia é um estado no qual um cromossomo de um par normal está duplicado. A maioria das não são compatíveis com a vida. Trissomia será relatada se existem cromossomos extras detectados. O relatório vai mostrar um “+” antes do cromossomo autossomo extra (cromossomos 1-22) e “anormal” no campo de resultado.
Deleção/Duplicação Parcial (del/dup):
A deleção ou duplicação indica que uma parte de um cromossomo está ausente ou adquirida. Deleções eduplicações diagnosticadas em um feto ou em nascidos vivos são geralmente associados com anomalias físicasou cognitivas. O relatório vai mostrar um “- / + p ou q” com a região do cromossomo que é deletadaouduplicada respectivamente.
Anormal Complexo:
Uma amostra embrionária será classificada como anormal complexo se houver uma combinação de cinco oumais achados anormais, incluindo monossomia, trissomia, e duplicação/deleção
Ausência de resultado:
Algumas vezes, apesar das tentativas de análise em milhões de loci genômicos, alguns cromossomos poderiamnão produzir sinais confiáveis. Quando não é possível a obtenção de um resultado com confiança elevada,aparecerá “Ausência de resultado” não sendo possível a informação cromossômica dessa amostra.
NOVOS ESTUDOS-NOVOS AVANÇOS
Estudo combina a análise cromossômica do DNA livre de células do embrião e sequenciamento SNP • DNA livre de células identificado no meio de cultura é uma mistura do DNA do embrião e materno, o que aumenta a complexidade do diagnóstico de embriões mosaico. • Resultados do estudo proporcionam melhor entendimento sobre a origem do DNA livre de células no meio de cultura, e representa um passo importante no desenvolvimento do cariótipo não invasivo baseado na informação do DNA liberado pelo embrião humano.
PGD – DETECÇÃO DE GENES ESPECÍFICOS
Quando um casal tem história familiar de alguma doença relacionada a algum gene específico, deve-se criar uma “sonda” específica para aquela família, a partir de amostra do sangue dos pais. São inúmeras as doenças possíveis de serem diagnosticadas (listadas abaixo). Pode-se ainda pesquisar compatibilidade HLA no embrião. Hoje, o Conselho Federal de Medicina permite que esta técnica seja utilizada para selecionar embriões compatíveis com outro filho do casal que tenha alguma doença que necessite de transplante ou células-tronco como tratamento.
Essa técnica pode ser utilizada em conjunto com o PGS.
A
AcidemiaGlutárica
AcidúriaMetilmalônica
Acondroplasia
Adrenoleucodistrofia
Agamaglobulinemia
Albinismo Ocular
Albinismo Oculocutâneo
Amaurose Congênita de Leber ligada ao X
Amiloidose
Anemia de Fanconi
Anemia Falciforme
Angioedema Hereditário
Aniridia
Antígeno KELL
Antitripsina Alfa
Ataxia Espinocerebelar do Tipo 1
Ataxia Espinocerebelar do Tipo 2
Ataxia Espinocerebelar do Tipo 3
Ataxia Espinocerebelar do Tipo 7
Atrofia Muscular Espinal
Atrofia Óptica
B
Braquidactilia
Braquidactilia – Síndrome de Hipertensão
C
Cadasil
Canavan
Câncer Hereditário de Mama e Ovário
Cardiomiopatia Hipertrófica
Cefalopolisindactilia de Greig ou Sídrome de Greig
Charcot-Marie-Tooth
Coroideremia
D
Deficiência da proteína B do surfactante pulmonar
Deficiência de CarnitinaTranslocaseAcilcarnitina
Deficiência de MCAD
Deficiência de OrnitinaTranscarbamilase
Deficiência de Receptor de LeucotrienosCisteínicos
Disautonomia Familiar ou Síndrome de Riley-Day
Disceratose Congênitav
Discinesia Ciliar
Displasia Cleidocranianav
Displasia Ectodérmica
Displasia Espondiloepifisaria
Distonia
Distonia de Torção
Distrofia de Sorsby
Distrofia Facioscapulohumeral
Distrofia Macular
Distrofia Miotônica
Distrofia Muscula de Emery-Dreifuss
Distrofia Muscular Congênita de Ulrich
Distrofia Muscular de Duchenne e Becker
Distrofia Muscular do Tipo Cinturas
Distrofia Muscular Miotônicav
Distúrbios Congênitos da Glicosilação
Doença da Urina em Xarope de Ácer
Doença de Darier
Doença de Fabry
Doença de Gaucher
Doença de Huntington
Doença de Huntington – Nondisclosing
Doença de Kennedy ou Atrofia Muscular Bulbar e Espinhal
Doença de Krabbe
Doença de Niemann-Pickv
Doença de Pompe
Doença de Tay Sachs
Doença de Wolman
Doença Granulomatosa Crônica
Doença Renal Policística
Doença Renal Policística Autossômica Recessiva
E
EpidermóliseBolhosa
Esclerose Tuberosa ou Síndrome de Bourneville-Pringle ou Epilóia
Espondilite Anquilosante
Exostose Múltipla
F
Fator V Leiden
Fenilcetonúria
Feocromocitoma
Fibrose Cística
G
Galactosemia
Gangliosidose GM1
Glicogenose
H
Hemofilia B
Hemofilia A
Hidrocefalia ligada ao X
Hiperglicinemia não cetótica
Hiperplasia Adrenal Congênita
Hipofosfatasia
HLA
Homocistinúria
I
Ictiose congênita – Harlequin
Imunodeficiência (NEMO)
Incontinência Pigmentar ou Síndrome de Bloch-Sulzberger
L
Leiomiomatose Hereditária
Leucodistrofia
Metacromática
Linfedema Hereditário
Linfohistiocitose
Hemofagocítica
Lipofuscionones
Ceróides Neuronais – Doença de Batten
M
Miastenia Gravis
Miocardiopatia Dilatada
Miopatia com corpos de inclusão associada a Doença de Paget de início precoce e
Demência Frontotemporal
MiopatiaMiotubular
MiopatiasDesmina-associadas
Mucolipidose II
Muscular Congênita com Deficiência da Merosina
N
Neoplasia Endocrina Múltipla
Neurofibromatose tipo 1
Neurofibromatose tipo 2
O
Osteogênese Imperfecta
Osteoporose
P
Pancreatite Hereditária
Paquioníquia Congênita
Paralisia Periódica Hipocalêmica
Polipose Adenomatosa Familiar
Pseudo-hipoparatireoidismo
Q
Querubismo
R
Retinite Pigmentar
Retinoblastomav
Retinosquise
RhD
S
Sexagem
Síndrome de Aarskog
Síndrome de Alagille
Síndrome de Alport
Síndrome de Denys-Drash
Síndrome de EhlersDanlos
Síndrome de Shwachman-Diamond
Síndrome Nefrótica Congênita do tipo Filandês
Síndrome Cornélia de Lange
Síndrome da Deficiência de Adesão Leucocitária
Síndrome da Fenda Palatina– Ectrodactilia
Síndrome de Bardet-Biedl
Síndrome de Birt-Hogg-Dubé
Síndrome de Cockayne
Síndrome de Displasia Oculodentodigital
Síndrome de Gerstmann-Straussle
Síndrome de Holt-Oram
Síndrome de Hunter
Síndrome de Hurler
Síndrome de Imunodeficiência Grave Combinada (SCID)
Síndrome de Joubert
Síndrome de Kallmann
Síndrome de Leigh
Síndrome de Li-Fraumeni
Síndrome de Marfan
Síndrome de MeckelGruber
Síndrome de Menkes
Síndrome de Noonan
Síndrome de Peutz-Jeghers
Síndrome de Rett
Síndrome de Rothmund-Thomson
Síndrome de Sanfilippo
Síndrome de Sathre-Chozen (Craniossinostose)
Síndrome de Sjögren-Larson
Síndrome de Smith-Lemli-Opitz
Síndrome de Treacher Collins
Síndrome de Usher
Síndrome de von Hippel-Lindau
Síndrome de Waardenburg
Síndrome de Wiskott-Aldrich
Síndrome de Zellweger
Síndrome do nevo-basocelular
Síndrome do QT longo
Síndrome do X-Frágil
Síndrome IPEX (imunodesregulação, poliendocrinopatia,
enteropatia ligadas ao X)
Síndrome Simpson-Golabi-Behmel
Síndrome Walker-Warburg
Síndromes de Crouzon, Apert e Pfeiffe
r
Surdez Autossômica Recessiva
Surdez relacionado ao gene OTOF
T
Talassemia Alfa
Talassemia Beta
Telangiectasia Hemorrágica Hereditária
Trombocitopenia com Talassemia Beta
V
VitreoretinopatiaExsudativa Familiar
REFERÊNCIAS BIBLIOGRÁFICAS:
1. Esfandiari N, Bentov Y, Casper RF. TrophectodermBiopsy for AneuploidyScreeningUsingDifferentPlatformsandConflicting Test Results. Munich, Germany: ESHRE O-034; 2014.
2. Gleicher N, Vidali A, Braverman J, Kushnir VA, Albertini DF, Barad DH. Furtherevidenceagainst use of PGS in poorprognosispatients: reportof normal birthsaftertransferofembryosreported as aneuploid. FertilSteril. 2015 Sep;104(Suppl 3):e59.
3. Mastenbroek S, Twisk M, van der Veen F, Repping S. Preimplantationgeneticscreening: a systematicreviewand meta-analysisofRCTs. HumReprod Update. 2011 Jul-Aug;17(4):454-66.
4. Orvieto R, Shuly Y, Brengauz M, Feldman B. Shouldpreimplantationgeneticscreeningbeimplementedtoroutineclinicalpractice? GynecolEndocrinol. 2016 Feb 12:1-3.
5. Scott RT Jr, Ferry K, Su J, Tao X, Scott K, Treff NR. Comprehensive chromosome screening is highly predictive of the reproductive potential of human embryos: a prospective, blinded, nonselection study. Fertil Steril. 2012 Apr;97(4):870-5.
6. Rodriguez, Maria Vera, Rubio, Carmen.Assessing the true incidence of mosaicism in preimplantationembryos :Fertility and Sterility 2017 May;Volume 107, (5): 1107-12.
As informações contidas neste site têm caráter informativo e educacional e, de nenhuma forma devem ser utilizadas para auto-diagnóstico, auto-tratamento e auto-medicação. Quando houver dúvidas, um médico deverá ser consultado. Somente ele está habilitado para praticar o ato médico, conforme recomendação do CONSELHO FEDERAL DE MEDICINA.

